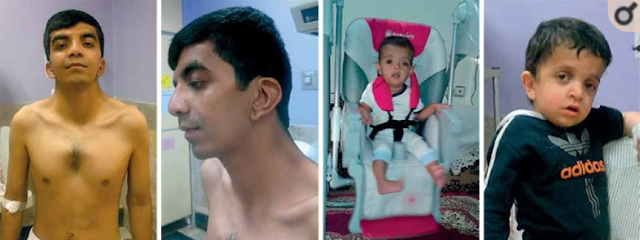
Diagnóstico clínico
El diagnóstico clínico del Síndrome de Noonan se basa en la asociación de
signos clínicos, la clasificación del Síndrome de Noonan de Van der Burgt es un método
basado en criterios mayores y menores, en la que el diagnóstico será definitivo
si cumple:
- Facies típicas + otro signo mayor o facies típicas + 2 signos menores
- Facies sugestivas + 2 signos mayores o facies sugestiva + 3 signos menores.
Pruebas moleculares (confirmación del diagnóstico)
Los enfoques de pruebas moleculares pueden incluir:
Panel multigénico: Incluye los genes mutados del SN y otros genes de interés (Diagnóstico diferencial). Es la prueba de elección para una persona con sospecha de tener el síndrome de Noonan. Los métodos utilizados en un panel pueden incluir análisis de secuencia, análisis de eliminación / duplicación y / u otras pruebas no basadas en secuenciación.
Single Gene Testing: Pueden considerarse si las pruebas de panel no son factibles. Aproximadamente el 50% de los individuos con SN tienen una variante de sentido patógeno en PTPN11; por lo tanto, la prueba de un solo gen que comienza con PTPN11 sería la siguiente mejor opción.
Se pueden considerar pruebas genómicas más completas (cuando estén disponibles), incluida la secuenciación del exoma o la secuenciación del genoma.
Diagnóstico prenatal
Examen de ultrasonido: Para embarazos con un riesgo del 50% es posible realizar una ecografía de alta resolución. Las características prenatales son inespecíficas, pero pueden incluir:
- Polihidramnios
- Hidronefrosis
- Derrame pleural
- Edema
- Defectos cardíacos
- Sacos linfáticos yugulares distendidos
- Higroma quístico
- Aumento de la translucidez nucal
El higroma quístico puede ir acompañado de edema del cuero cabelludo, polihidramnios, derrames pleurales y pericárdicos, ascitis y / o hidropesía fetal franca.
Si hay antecedentes del SN se recolecta una muestra del ADN del feto usando una muestra de vellosidades coriónicas o una amniocentesis y se procede a la detección de cualquiera de los genes defectuosos asociados con la enfermedad.
Disponible en:
Imagen disponible en:
Link 1:
Link 2:
Tabla 1 disponible en: