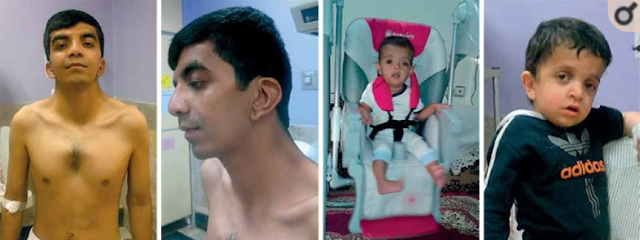
Modo de herencia
NS se hereda de manera autosómica dominante.
Riesgo para los miembros de la familia
El 30% -75% de las personas diagnosticadas con NS tienen un padre afectado.
El riesgo para los hermanos de un
probando depende del estado genético de los padres:
- Cada hijo de un individuo con síndrome de Noonan tiene un 50% de probabilidades de heredar la variante patógena.
- Cuando los padres no están afectados clínicamente, y la variante patógena relacionada con NS que se encuentra en el probando no se puede detectar en el ADN de leucocitos de ninguno de los padres, el riesgo para los hermanos de un probando parece ser bajo (<1%) pero mayor que el de la población general debido a la posibilidad de mosaicismo de la línea germinal
En casos simplex o de novo (es decir, aquellos sin antecedentes familiares conocidos), el alelo mutado suele ser de origen paterno. La edad paterna avanzada y el predominio en la transmisión a los hombres (un hallazgo que hasta ahora no se ha explicado) son factores de riesgo.
Comprensión
Es apropiado evaluar a ambos padres, incluido un examen físico completo con especial atención a las características de NS; ecocardiografía y eco; cribado de coagulación; y revisión de las fotografías de la cara en todas las edades, en busca de los rasgos característicos de la SN. Las pruebas genéticas moleculares de los padres son posibles si se conoce la variante patógena en el probando.
Opciones reproductivas
Una vez calculado el riesgo del futuro hijo, la pareja puede tomar medidas para reducirlas:
Embarazo de alto riesgo: Una vez que se ha identificado la variante patógena relacionada con NS en un miembro de la familia afectado, es posible realizar pruebas prenatales para un embarazo con mayor riesgo y un diagnóstico genético preimplantacional para NS.
Embarazo de bajo riesgo: Aunque los hallazgos ecográficos sugieran el diagnóstico de NS en embarazos de alto riesgo, no son específicos y pueden estar asociados con defectos cardiovasculares u otros síndromes cromosómicos y no cromosómicos.
Nota: La
Constitución del Ecuador 2008, Art. 362 garantiza el
consentimiento informado, el acceso a la información y la confidencialidad
de la información de los pacientes.
Disponible en:
Link 1: https://www.ncbi.nlm.nih.gov/books/NBK1124/#noonan.Diagnosis
Link 2:
https://www.centogene.com/science/centopedia/ngs-panel-genetic-testing-for-noonan-syndrome.html
Link 3:
https://www.salud.gob.ec/wp-content/uploads/2014/11/MSP_Consentimiento-Informado_-AM-5316.pdf
Imagen disponible en:
Link 1: https://infogen.org.mx/wp-content/uploads/2014/02/cg01.jpg
Link 2: http://www.miguel-a.es/FOLL/11-HDOMI.htm